Pandémie
USA: demande d'autorisation pour un traitement anti-Covid aux anticorps, le même qui a été administré à Trump
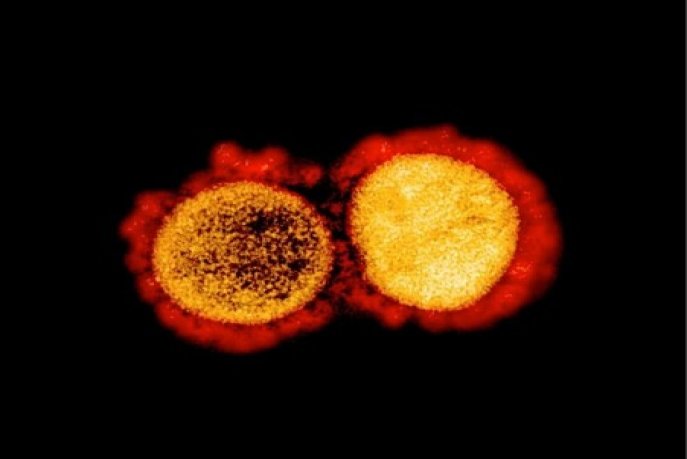
Une image du virus SARS-CoV-2 transmise par les Instituts nationaux de santé (NIH/NIAD) le 11 août 2020
Ils sont malins au laboratoire pharmaceutique américain Eli Lilly qui a annoncé mercredi qu'il avait déposé une demande d'autorisation en urgence pour un traitement aux anticorps de synthèse contre le Covid-19, de la même catégorie que le médicament injecté au président Donald Trump la semaine dernière. Si on leur oppose un refus, il peut toujours dire si ce médicament est bon pour le président, il est bon pour tous les Américains.
M. Trump, infecté par le coronavirus, a reçu le traitement d'une autre société, Regeneron, qui elle n'a pas encore fait de demande d'autorisation et poursuit les essais cliniques. Cette voie est jugée prometteuse pour stopper le coronavirus aux stades initiaux de l'infection.
"Nos équipes ont travaillé sans relâche depuis sept mois pour découvrir et développer ces traitements potentiels aux anticorps", a déclaré le directeur scientifique de Eli Lilly, Daniel Skovronsky. "Lilly travaille assidûment avec les régulateurs du monde entier pour rendre ces traitements disponibles".
Le traitement est fondé sur des anticorps spécifiquement adaptés pour la neutralisation du coronavirus.
Selon le groupe, un essai clinique sur 268 patients souffrant de formes légère ou modérée du Covid-19, avec placebo, a démontré qu'un cocktail de deux types d’anticorps :
- réduisait la charge virale (3% des patients avaient une forte charge virale au 7e jour de la maladie, contre 21% dans le groupe placebo);
- réduisait les symptômes dès le troisième jour après l’injection ;
- réduisait le taux d'hospitalisations et de visites aux urgences (0,9% contre 5,8% dans le groupe placebo).
Le groupe a demandé une autorisation pour un seul type d'anticorps à ce stade.
L'Agence américaine des médicaments (FDA) devra étudier les données, et notamment les éventuels effets secondaires, pour décider d'autoriser ou non la commercialisation du traitement, et sous quelles conditions.
Les résultats n'ont pas été publiés dans une revue scientifique avec comité de lecture, ce qui aurait permis de valider indépendamment la méthodologie.
L'essai clinique se poursuit et la société veut recruter un total de 800 participants.
100.000 doses de la monothérapie (un seul anticorps) seront disponibles en octobre, et un million d'ici la fin de l'année, selon Lilly, ainsi que 50.000 doses du cocktail de deux anticorps d'ici la fin de l'année.
Les anticorps sont des protéines du système immunitaire qui combattent les infections. Ils sont présents et peuvent être prélevés dans le sang des patients rétablis, mais les anticorps naturels ainsi récupérés ne peuvent pas servir à des traitements à grande échelle.